מונעים אסונות עתידיים: מודל חישובי למחלת לב גנטית
המודל החישובי של החלבון הפגום RyR2, שפותח על ידי ד"ר יוליה עינב ושותפיה, עשוי לשמש כבסיס לכלי אבחוני מהיר ויעיל עבור מגוון רחב של מחלות גנטיות מסכנות חיים.
המאמר פורסם בכתב העת היוקרתי של האגודה האמריקאית למחלות לב ((Journal of the American Heart Association

ד"ר יוליה עינב
ד"ר יוליה עינב מהמחלקה לביו-הנדסה בפקולטה להנדסה של המכון הטכנולוגי חולון זוכרת היטב את שיחת הטלפון שקיבלה בינואר 2017. על הקו היה פרופ' דוד לוריא, מומחה בעל מוניטין לאלקטרו-קרדיולוגיה מהמרכז הרפואי הדסה בירושלים, שביקש ממנה לסייע בפיענוח מוטציה חדשה שהתגלתה זה עתה במחלקתו. לדבריו, המוטציה גרמה לאחרונה לדום לב פתאומי בארבעה ילדים בני משפחה אחת מכפר ליד ירושלים, ביניהם ילדה שנפטרה על גלגל ענק בלונה פארק, בעיצומה של החוויה המרגשת. ד"ר עינב, שמכירה אישית את הנושא מכיוון שאחיה סובל ממום מולד בלבו, נענתה מיד לאתגר החדש.
פרופ' לוריא (שכפי שהתברר בהמשך, ניתח פעמיים את אחיה של ד"ר עינב, והציל את חייו), דיווח לד"ר עינב על ממצאיו: הגורם להפרעה בקצב הלב, וכתוצאה מכך לדום לב בארבעת הילדים, הינו מוטציה בגן הקרוי RyR2, המקודד לחלבון של תעלה המעבירה לשריר הלב יוני סידן החיוניים להתכווצותו. כשהחלבון הזה פגום, תפקוד התעלה נפגע - מצב שעלול לגרום לדום לב בכל רגע, בעיקר בעת התרגשות, בהלה פתאומית וכד'. עד היום זוהו מאות מוטציות בגן RyR2, ועל פי ההערכה הן אחראיות לכ-10% ממקרי המוות כתוצאה מדום לב בגיל צעיר. אך המקרה של המשפחה בהדסה היה שונה מכל המוטציות הידועות ב-RyR2, בעיקר בדפוס התורשה של המוטציה בתוך המשפחה. כדי להבין אותה לעומק ולסייע למשפחה הנפגעת, וגם למנוע מקרים דומים בעתיד, ביקש פרופ' לוריא את עזרתה של ד"ר עינב.
"המומחיות שלי היא בניית מודלים חישוביים של מולקולות חלבון," מסבירה ד"ר עינב. "באמצעות המידע שקיבלנו מהדסה בנינו מודל חישובי של החלבון RyR2 של הילדים החולים, והשווינו אותו לחלבון בריא, וכן לחלבוני RyR2 פגומים אחרים המוכרים מהספרות. המודלים הובילו אותנו לשתי תגליות חשובות."
ראשית, נמצא כי המוטציה החדשה בחלבון RyR2 היא רצסיבית, וזאת בניגוד לכל המוטציות שהיו מוכרות עד אז בגן זה, שכולן דומיננטיות. "המשמעות היא שכדי שייוולד ילד חולה, שחייו בסכנה בכל רגע, עליו לקבל את הגן הפגום משני הוריו," אומרת ד"ר עינב. "בנוסף, כששני ההורים נושאים את המוטציה, יש לכל ילד סיכוי של 25% ללקות במחלה. עובדה זו מסבירה מדוע המוטציה החדשה נדירה יותר מאחרות, ומדוע היא הופיעה דווקא במשפחה שבה נישואי קרובים הם דבר מקובל. הרצסיביות אף מבהירה מדוע המוטציה לא התגלתה במשך זמן רב: ההורים שהם נשאים של המוטציה כלל לא ידעו על כך, מכיוון שלא לא היו חולים בעצמם."
הממצא המשמעותי השני של ד"ר עינב ושותפיה היה מיקומה של המוטציה בחלבון עצמו: "בניגוד לכל המוטציות המוכרות בחלבון זה, מוטציה זו נמצאת במקום פריפריאלי בחלבון. כל המוטציות האחרות קרובות לאזור החשוב ביותר בחלבון - המקום שבו התעלה לוכדת את יון הסידן ומעבירה אותו אל שריר הלב. המוטציה החדשה, לעומת זאת, משפיעה על תפקוד התעלה מרחוק. זו הפעם הראשונה שתופעה זו, המכונה אלוסטריות, מתגלה בתעלת היונים הזאת."
ד"ר עינב וקבוצתה בנו מגוון מודלים חישוביים של החלבון כדי לבחון מצבים שונים – שבהם המוטציה עוברת בתורשה מהורה אחד או משניהם, והראו שמוטציה זו בחלבון RyR2 היא תלוית מינון. במילים אחרות, כשהמוטציה מרוחקת מאזור תעלת הסידן, דרוש מינון גבוה יותר – שני עותקים של הגן הפגום, משני ההורים – ולכן המוטציה היא רצסיבית. במובן זה היא שונה ממוטציות מוכרות אחרות בגן זה, הממוקמות באזור המרכזי, ולכן דרוש רק עותק אחד כדי שהמחלה תופיע, והמוטציה היא דומיננטית.
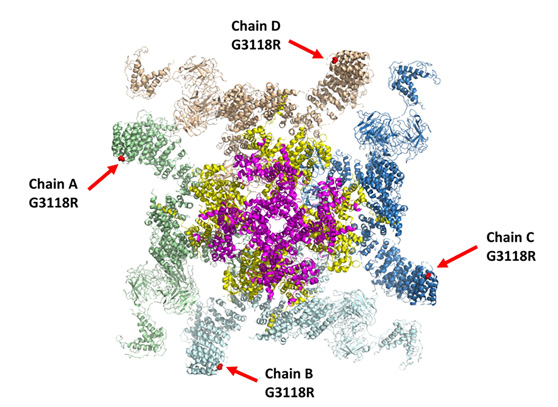
מודל חישובי של מוטציה RyR2 במחקר
הממצאים הללו (לצד בדיקות פונקציונליות של תעלת RyR2 שבוצעו באוניברסיטת קלגרי בקנדה) אפשרו לרופאים בהדסה להציע עזרה למטופליהם. כל בני המשפחה שבה התגלתה המוטציה עברו בדיקה גנטית, וכך אותרו והוזהרו כמה אנשים נוספים בעלי שני עותקים של הגן הפגום. בנוסף הוצע למשפחה ייעוץ גנטי, במטרה למנוע נישואין בין שני נשאים של המוטציה ו/או לאפשר אבחון טרום-לידתי של המחלה.
אך החוקרים לא הסתפקו בכך. הם סבורים שהמודל החישובי שבנו עבור המקרה הספציפי יכול לשמש כבסיס לפיתוח כלי אבחוני רחב הרבה יותר. "כעת אנו מפתחים אלגוריתם שיכול להציג לרופא את המשמעות הקלינית של כל מוטציה בגן RyR2, בלחיצת מקש," אומרת ד"ר עינב. "לאחר שנמצא כי חולה מסוים נושא מוטציה בגן זה, הרופא יזין את נתוניו למערכת, ויקבל מיד אבחנה מדויקת, כולל תשובה לשאלה הקריטית: האם החולה מצוי בסיכון לדום לב פתאומי? בנוסף, מכיוון שתעלת הסידן בה עסק המחקר דומה לתעלות יונים רבות אחרות בגוף (המעבירות יוני סידן, נתרן או אשלגן), בעלות תפקידים מגוונים - מכיווץ שרירים ועד להעברת אותות עצביים ושחרור הורמונים, החלטנו לפתח כלי אבחון דומים גם עבור תעלות יונים נוספות."
בסופו של דבר, כך מקווים החוקרים, יוביל מחקרם לפיתוח מגוון כלי אבחון מהירים ומדויקים עבור מוטציות שונות הפוגעות בתעלות יונים, וגורמות למחלות גנטיות רבות המסכנות את חייהם ו/או את איכות חייהם של מיליוני בני אדם בכל העולם.
כתובית לאיור. מודל חישובי של מוטציית RyR2 שבה עוסק המחקר
תעלת הסידן של RyR2 בנויה מארבע מולקולות חלבון, המוצגות כאן בצבעים שונים (ירוק, חום, כחול ותכלת). מיקומה של המוטציה בכל חלבון מוצג כנקודה אדומה המסומנת על ידי חץ אדום. מוטציה זו, הממוקמת בפריפריה של החלבון, מעוותת חלקים מרכזיים של התעלה, המסומנים בוורוד ובצהוב.
פורסם: 11/4/2021



